段燕文,我校84级校友。3月16日,段燕文教授团队在药剂学权威期刊美国化学学会旗下《Molecular Pharmaceutics》,以论著形式在线发表了题为“Liposome-Encapsulated Tiancimycin A Is Active against Melanoma and Metastatic Breast Tumors:The Effect of cRGD Modification of Liposomal Carrier and Tiancimycin A Dose on Drug Activity and Toxicity”的研究成果。该研究成果表明烯二炔类新化合物具有极高的成药性。
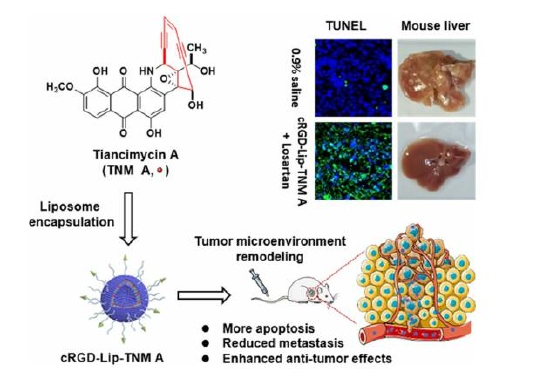
癌症是危害人类生命健康的重大疾病,设计和合成高效低毒的新型抗肿瘤药物迫在眉睫。用于癌症治疗的纳米医学主要目标是选择性地靶向癌细胞,减少与健康组织的非特异性相互作用,降低毒副作用并提高治疗效果。段燕文团队长期致力于通过合成生物学技术获取新结构新靶点潜在抗肿瘤药物先导化合物,并进行转化型研究和产业化开发。前期通过高通量筛选烯二炔天然产物潜在生产菌株,并基于抗生素抗性诱导的核糖体工程,获得了天赐霉素(Tiancimycin A)高产菌株。Tiancimycin A是一种有着全新结构的高效抗肿瘤抗生素,但由于毒性较强使其临床应用受限。在此,研究团队采用了一种以脂质体为载体,构建了(Lip-TNM A)和环状精氨酸-甘氨酸-天冬氨酸(cRGD)功能化脂质体(cRGD-Lip-TNM A)的纳米策略,以增强其体内外抗肿瘤活性。该给药系统在小鼠黑色素瘤B16-F10模型和乳腺癌KPL-4模型均表现出良好的抗肿瘤治疗效果。这一研究显示了纳米递送烯二炔抗肿瘤药物的临床转化巨大潜力。
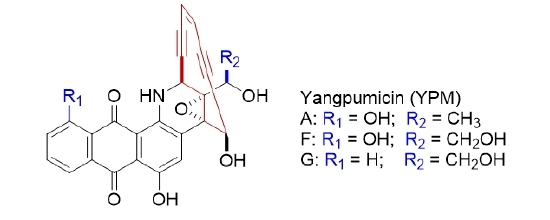
前期,段燕文团队通过独创的基因垂钓技术获得新型烯二炔类天然产物结构类似物,并被分别命名为洋浦霉素F和G。值得一提的是,这两个分子物均包含一个在蒽醌骈合型烯二炔中独特的邻二醇结构,可更方便地与抗体偶联,有望成为未来抗体偶联药物的弹头分子。继洋浦霉素系列分子物结构和活性获得发明专利授权后(CN201910316797.9),通过对洋浦霉素产生菌的核糖体工程策略和规模化发酵优化,段燕文团队将洋浦霉素的产量提高了约11倍。成功建立起洋浦霉素的高表达工程菌和生物发酵新型中试生产工艺,将有助于推动洋浦霉素开发成临床抗癌药物。这一成果在国际生物技术权威期刊《Biotechnology Journal》(02 September 2021),以论著形式在线发表了题为“Yield improvement of enediyne yangpumicins in Micromonosporayangpuensis through ribosome engineering and fermentation optimization”的最新研究成果。


结核病(TB)及其不断演变的耐药性对全球健康构成了严重威胁,每年会导致超过150万人死亡。因此开发新型抗结核抗生素仍然至关重要。段燕文团队与中国科学院南海海洋研究所开展源于海洋微生物资源开发与利用合作研究。Ilamycin-E1/E2 是从海洋 Streptomyces atratus SCSIO ZH16-ΔilaR 突变株获得的一对环肽对映异构体,其作为有前景的药物先导化合物具有显著的抗结核分枝杆菌活性(MIC = 9.8 nM),但其临床开发受到分子物来源有限,低发酵产量的严重阻碍。我们通过Plackett-Burman(PB)模型,首先筛选出细菌蛋白胨这一显著负因素。随后替换成了麦芽提取粉,产量在摇瓶及发酵罐中得到了显著提升,最终在300L发酵罐放大生产,产量达到了415.7±29.2 mg/L,相比原始培养基提高了 30.5 倍。这项研究为获得足够的ilamycin-E1/E2先导化合物提供了坚实的基础,并极大支持了其潜在的抗结核药物开发。团队接连在国际生物技术权威期刊《Biotechnology Journal》(31 January 2022)上,发表了题为“Medium optimization and subsequent fermentative regulation enabled the scaled-up production of anti-tuberculosis drug leads ilamycin-E1/E2”的创新成果。
该团队的研究获得了国家111计划、国家自然科学基金重点项目、面上项目的支持。